Eine Säure-Base-Titration ist eine Titration, bei der Protonen von einem Reaktionspartner auf den anderen Reaktionspartner übertagen werden. Die Säure-Base-Titration wird auch als Neutralisationstitration, Neutralisationsanalyse, pH-Titration oder pH-metrische Titration bezeichnet.
Ein Beispiel für eine Säure-Base-Titration ist die Bestimmung von Salzsäure mit Natronlauge:
HCl + NaOH → NaCl + H2O
Zu unterscheiden sind bei Säure-Base-Titrationen die Alkalimetrie bzw. alkalimetrische Titration und die Acidimetrie bzw. acidimetrische Titration. Bei der Alkalimetrie wird eine saure Probelösung bestimmt, indem sie mit einer basischen Maßlösung titriert wird. Bei der Acidimetrie verhält es sich umgekehrt: eine basische Probelösung wird mittels einer sauren Maßlösung analysiert.
Zur Erkennung des Äquivalenzpunkts einer Säure-Base-Titration kann entweder ein pH-Indikator verwendet werden oder die Indikation erfolgt physikalisch, wenn eine Leitfähigkeitstitration oder eine potentiometrische Titration durchgeführt werden. Dazu kann auch ein Titrator verwendet werden.
Bei einer potentiometrischen Indikation können Gemische von Säuren beziehungsweise Basen simultan titriert werden, sofern die Unterschiede in den pKS-Werten ausreichend groß sind.
Inhaltsverzeichnis
Grundlagen der Säure-Base-Titration
Säuren und Basen
Nach Brönsted und Lowry ist eine Säure eine Substanz, die Protonen (H+) abgeben kann, ein sogenannter Protonendonor. Eine Base kann dagegen Protonen aufnehmen, es handelt sich um einen sogenannten Protonenakzeptor. Aus dieser Definition ergibt sich die folgende schematische Reaktionsgleichung:
Säure (S) ↔ Base (B) + Proton (H+)
Beispiel:
HCl ↔ Cl– + H+
Durch die Abgabe eines Protons wird aus der Säure eine Base, die sogenannte korrespondierende oder konjugierte Base, wohingegen aus der Base nach der Aufnahme eines Protons die korrespondierende oder konjugierte Säure wird. Die Säure und ihre konjugierte Base bilden ein korrespondierendes Säure-Base-Paar. Dabei können die Säure und die Base jeweils neutral, positiv geladen oder negativ geladen sein.
Aufgrund ihrer großen Reaktionsfähigkeit können freie Protonen in Lösungen allerdings nicht vorkommen. Folglich benötigt eine Säure zur Protonenabgabe stets eine Base und eine Säure-Base-Reaktion kann nur stattfinden, wenn zwei korrespondierende Säure-Base-Paare vorhanden sind:
S1 + B2 ↔ B1 + S2
Beispiel:
HCl + H2O ↔ Cl– + H3O+
Nach Brönstedt und Lowry handelt es sich bei einer Säure-Base-Reaktion also um eine Protonenübertragung, die auch als Protolyse bezeichnet wird.
Aus der Übertragung eines Protons auf ein Wassermolekül resultiert das Oxoniumion H3O+, dessen hydratisierte Form auch als Hydroniumion bezeichnet wird. Wassermoleküle können aber nicht nur Protonen aufnehmen, sondern auch als Säure reagieren und Protonen abgeben. Die dabei entstehenden OH–-Ionen werden Hydroxidionen genannt. Verbindungen, die sowohl als Säure als auch als Base reagieren können, werden als Ampholyte bezeichnet.
Stärke von Säuren und Basen
Die Stärke von Säuren und Basen ergibt sich aus ihrer Neigung zur Abgabe beziehungsweise Aufnahme von Protonen. Da für eine Säure-Base-Reaktion stets zwei korrespondierende Säure-Base-Paare erforderlich sind, kann die Stärke von Säuren und Basen nur relativ bestimmt werden. Als Referenz dient üblicherweise Wasser.
Für eine Säure ergibt sich damit das folgende Protolysegleichgewicht:
HA + H2O ↔ A– + H3O+
Je stärker die Säure ist, desto stärker liegt das Gleichgewicht auf der rechten Seite. Zur Quantifizierung der Säurestärke dienen die Säurekonstante KS und der Säureexponent pKS. Es gilt: je größer KS, desto stärker die Säure und je kleiner pKS, desto stärker die Säure.
| Sehr starke Säure | pKS ≤ -1,74 |
| Starke Säure | pKS = -1,74 bis 4,5 |
| Schwache Säure | pKS = 4,5 bis 9,5 |
| Sehr schwache Säure | pKS = 9,5 bis 15,74 |
| Extrem schwache Säure | pKS ≥ 15,74 |
Für eine Base gilt entsprechend, dass das Gleichgewicht auch hier umso stärker auf der rechten Seite liegt, je stärker die Base ist:
B + H2O ↔ BH+ + OH–
Analog verhält es sich auch mit der Basekonstante KB und dem Baseexponent pKB: je größer KB, desto stärker die Base und je kleiner pKB, desto stärker die Base.
| Sehr starke Base | pKB ≤ -1,74 |
| Starke Base | pKB = -1,74 bis 4,5 |
| Schwache Base | pKB = 4,5 bis 9,5 |
| Sehr schwache Base | pKB = 9,5 bis 15,74 |
| Extrem schwache Base | pKB ≥ 15,74 |
Für ein korrespondierendes Säure-Base-Paar in Wasser gilt darüber hinaus:
KS ∙ KB = KW = 10-14 mol2 ∙ L-2 bei 24 °C
und
pKS + pKB = pKW = 14
Nachfolgend sind einige Säure-Base-Paare aufgeführt, wobei die Werte der Säure- und Baseexponenten für ca. 0,1 bis 0,01 m wässrige Lösungen und 25 °C gelten:
| pKS | Säure | Base | pKB |
| ca. -9 | HClO4 | ClO4– | ca. 23 |
| ca. -8 | HI | I– | ca. 22 |
| ca. -6 | HBr | Br– | ca. 20 |
| ca. -3 | HCl | Cl– | ca. 17 |
| ca. -3 | H2SO4 | HSO4– | ca. 17 |
| -1,74 | H3O+ | H2O | 15,74 |
| -1,32 | HNO3 | NO3– | 15,32 |
| 1,25 | C2O4H2 | C2O4H– | 12,75 |
| 1,76 | H2SO3 | HSO3– | 12,24 |
| 1,99 | HSO4– | SO42- | 12,01 |
| 2,23 | H3PO4 | H2PO4– | 11,77 |
| 2,22 | [Fe(H2O)6]3+ | [Fe(H2O)5(OH)]2+ | 11,78 |
| 3,17 | HF | F– | 10,83 |
| 3,25 | HNO2 | NO2– | 10,75 |
| 3,75 | HCOOH | HCOO– | 10,25 |
| 4,28 | C2O4H– | C2O42- | 9,72 |
| 4,75 | CH3COOH | CH3COO– | 9,25 |
| 4,85 | [Al(H2O)6]3+ | [Al(H2O)5(OH)]2+ | 9,15 |
| 6,35 | H2CO3 | HCO3– | 7,65 |
| 7,00 | H2S | HS– | 7,00 |
| 7,20 | HSO3– | SO32- | 6,80 |
| 7,21 | H2PO4– | HPO42- | 6,79 |
| 9,28 | H3BO3 | H2BO3– | 4,72 |
| 9,25 | NH4+ | NH3 | 4,75 |
| 9,32 | HCN | CN– | 4,68 |
| 9,61 | [Zn(H2O)6]2+ | [Zn(H2O)5(OH)]+ | 4,39 |
| 10,25 | HCO3– | CO32- | 3,75 |
| 11,65 | H2O2 | HO2– | 2,35 |
| 12,32 | HPO42- | PO43- | 1,68 |
| 12,75 | H2BO3– | HBO32- | 1,25 |
| 12,92 | HS– | S2- | 1,08 |
| 13,80 | HBO32- | BO33- | 0,20 |
| 15,74 | H2O | OH– | -1,74 |
Wie die Tabelle zeigt, gibt es neben einwertigen Säuren wie HClO4, die nur ein Proton abgeben können, auch mehrwertige Säuren wie H2SO4. Die Protolyse mehrwertiger Säuren erfolgt in mehreren Protolysestufen, sodass sich mehrere Säurekonstanten ergeben.
Wie das Beispiel von H2SO4 mit den pKS–Werten von ca. -3 für das Säure-Base-Paar H2SO4 und HSO4– sowie 1,99 für das Säure-Base-Paar HSO4– und SO42- zeigt, steigen die pKS–Werte bei der Protolyse von Stufe zu Stufe an. Der Grund ist, dass die negative Ladung nach jeder Protonenabgabe zunimmt, was die Abgabe des jeweils nächsten Protons erschwert.
Analog verhält es sich bei Basen, bei denen man einwertige und mehrwertige Basen unterscheiden kann.
Titrationskurven von Säure-Base-Titrationen
Titrationskurven von Säure-Base-Titrationen sind Auftragungen des pH-Werts der vorgelegten Lösung gegen den Titrationsgrad τ. Der Titrationsgrad τ entspricht dem Verhältnis der Äquivalentstoffmenge des zugesetzten Reagenzes zur Äquivalentstoffmenge des zu analysierenden Stoffes in der ursprünglichen Probelösung.
Titration starker oder sehr starker Säuren und Basen
Betrachtet man beispielsweise die Titration von Salzsäure (Konzentration = 0,01 mol/L) mit Natronlauge (Konzentration = 1 mol/L) so ergibt sich die nachfolgende Titrationskurve.
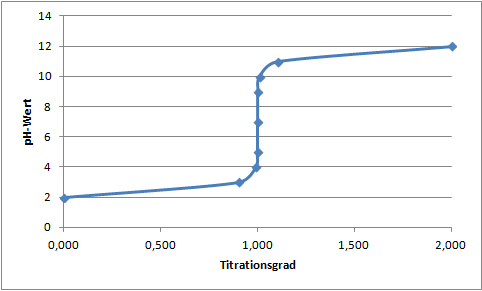
So lange noch keine Natronlauge zugesetzt wurde, also beim Titrationsgrad 0, beträgt der pH-Wert der Probelösung 2. Es befinden sich folglich mehr H3O+– als OH–-Ionen in der Lösung. Wird jetzt langsam Natronlauge zugesetzt, erhöht sich der pH-Wert, da sich die zugesetzten OH–-Ionen mit H3O+-Ionen aus der Probenlösungen zu Wasser verbinden.
Irgendwann wird schließlich ein pH-Wert von 7 und damit der Neutralpunkt erreicht. Wenn jetzt weiter titriert wird, befinden sich mehr OH–– als H3O+-Ionen in der Lösung und diese wird zunehmend basisch. Der pH-Wert nimmt also weiter zu.
Aus der Titrationskurve kann abgelesen werden, dass der pH-Wert zunächst nur langsam ansteigt. Im weiteren Verlauf der Titration wird der Anstieg zunehmend steiler, bevor es einen Sprung gibt, nach dem der Anstieg dann wieder flacher wird. Der Punkt des stärksten pH-Wert-Anstiegs, also der Wendepunkt der Kurve, ist der Äquivalenzpunkt der Titration.
Das Ziel jeder Säure-Base-Titration besteht darin, diesen Äquivalenzpunkt so exakt wie möglich zu erfassen. Wie eingangs bereits erwähnt kann der Äquivalenzpunkt mit einem pH-Indikator, aber auch durch eine Leitfähigkeitstitration oder eine potentiometrische Titration bestimmt werden.
Bei der Titration einer starken oder sehr starken Säure mit einer starken oder sehr starken Base fallen der Äquivalenzpunkt und der Neutralpunkt, also der Punkt, bei dem der pH-Wert 7 beträgt, zusammen.
Wenn die Konzentration der Probenlösung variiert wird, ändert sich die Kurvenform im Prinzip nicht, der Sprung am Äquivalenzpunkt ist allerdings umso größer, je höher die Konzentration der Probenlösung ist.
Bei der Titration einer starken Base mit einer starken Säure wird die Titrationskurve prinzipiell umgekehrt durchlaufen, also von einem hohen pH-Wert zu einem niedrigen pH-Wert.
Titration schwacher Säuren und Basen
Im Gegensatz zur eben beschriebenen Titration einer starken oder sehr starken Säure mit einer starken oder sehr starken Base liegt der Äquivalenzpunkt bei der Titration einer schwachen Säure mit einer starken oder sehr starken Base oberhalb des Neutralpunkts.
Titriert man beispielsweise Essigsäure (Konzentration = 0,1 mol/L) mit Natronlauge (Konzentration = 10 mol/L) so ergibt sich die nachfolgende Titrationskurve.
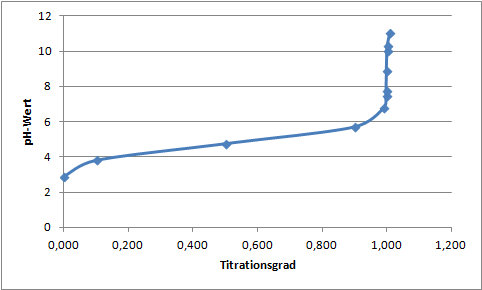
Die Kurve zeigt, dass der Äquivalenzpunkt erst bei einem pH-Wert deutlich über 7 erreicht wird. Die Ursache dieses Verlaufs besteht darin, dass das Protolysegleichgewicht der Essigsäure weit auf der linken Seite liegt. Am Äquivalenzpunkt sind also mehr OH–-Ionen in der Lösung als H3O+-Ionen.
Bei der Titration einer Säure mit einer starken Base ist der Anstieg des pH-Werts am Äquivalenzpunkt umso stärker, je stärker die titrierte Säure ist. Darüber hinaus weichen der Äquivalenzpunkt und der Neutralpunkt umso stärker voneinander ab, umso schwächer die titrierte Säure ist.
Durchführung von Säure-Base-Titrationen
Für die Analyse einer Probe mittels Säure-Base-Titration ist es erforderlich, die verwendete Maßlösung einzustellen und deren Titer zu berechnen.
Einstellung von Säuren
Als Maßlösungen für die Acidimetrie werden häufig Salzsäure oder Schwefelsäure verwendet, weniger häufig ist die Verwendung von Salpetersäure oder Perchlorsäure. Gelegentlich wird außerdem auch Oxalsäure eingesetzt. Übliche Konzentrationen der Säuren sind 0,1, 0,2, 0,5 und 1 mol/L.
Bei den starken Säuren lassen sich die Maßlösungen mit der gewünschten Konzentration aus den reinen konzentrierten Lösungen herstellen, Oxalsäurelösungen können aus Oxalsäuredihydrat produziert werden.
Als Urtitersubstanzen für Säuremaßlösungen können prinzipiell die folgenden Substanzen verwendet werden:
- Natriumcarbonat
- Natriumoxalat
- Kaliumhydrogencarbonat
- Quecksilberoxid
Einstellung von Laugen
Als Maßlösungen für die Alkalimetrie werden primär Natronlauge oder Kalilauge mit einer Konzentration von 0,2 oder 0,1 mol/L verwendet. Diese Maßlösungen müssen außerdem möglichst carbonatfrei sein, da Carbonat den Farbumschlag von pH-Indikatoren wie Methylorange und Phenolphthalein stören kann. Eine meist ausreichend carbonatarme Natronlauge lässt sich aus Natriumhydroxid herstellen, während für eine völlig carbonatfreie Natronlauge metallisches Natrium erforderlich ist.
Zur Einstellung der Laugen können Säuren entsprechender Äquivalentkonzentration mit bekanntem Titer verwendet werden.
Alternativ können die Laugen auch mit einer geeigneten Urtitersubstanz eingestellt werden, beispielsweise:
- Oxalsäuredihydrat
- Benzoesäure
- Kaliumhydrogenphthalat
- Amidosulfonsäure
Bestimmungen mittels Säure-Base-Titration
Zur Titration starker und schwacher Basen werden grundsätzlich starke Säuren verwendet, wobei die Stoffmengenkonzentration der Probe ungefähr der Stoffmengenkonzentration der Maßlösung entsprechen sollte. Beispiele für Bestimmungen starker und schwacher Basen sind:
- Gesamtalkaligehalt von technischem Natriumhydroxid
- Carbonate sowie Hydroxide und Carbonate nebeneinander
- Carbonat und Hydrogencarbonat nebeneinander
- Borax
- Kjeldahl-Methode
- Stickstoffgehalt von Salpeter
- Stickstoffgehalt von Steinkohle
- Gesamtstickstoffgehalt von Gartendünger
- Wasserfreie Titrationen von Nicotinamid, Fenbendazol und Pantoprazol
- Formaldehyd nach dem Sulfitverfahren
Zur Titration starker und schwacher Säuren werden starke Laugen wie NaOH oder KOH verwendet, wobei die Stoffmengenkonzentration der Probe auch hier ungefähr der Stoffmengenkonzentration der Maßlösung entsprechen sollte. Beispiele für Bestimmungen starker und schwacher Säuren sind:
- Analyse von Schwefelsäure
- Analyse von Essigsäure
- Analyse von Borsäure
- Analyse von Magnesium
- Analyse von Ammoniumsalzen
- Analyse von Phosphorsäure
- Bestimmung der Säurezahl
- Bestimmung der Verseifungszahl
- Bestimmung der Esterzahl
- Analyse von Ethinylestradiol
- Analyse von Salicylsäure
Eine in der metallorganischen Chemie relevante Säure-Base-Titration ist die Gilman-Titration zur Bestimmung des Gehalts von Lithiumorganylen, insbesondere n-Butyllithium (n-BuLi), in einem Lösungsmittel.
Weiterführende Quellen
Gilman, H. / Cartledge, F. K. (1964): The analysis of organolithium compounds. In: J. Organomet. Chem., Vol. 2, Issue 6, 447-454.
Jander, G. / Jahr, K. F. (2017): Maßanalyse – Titrationen mit chemischen und physikalischen Indikationen, 19. Auflage, Berlin / Boston